অতিথি লেখক: রউফুল আলম
লেখক ও গবেষক
ইমেইল: [email protected]
রাসায়নিক বিক্রিয়া, বিশেষত জৈব রসায়নের বিক্রিয়া বুঝতে হলে, ব্যাখ্যা করতে হলে নিচের কয়েকটি বিষয়ে ভালো ধারণা থাকতে হবে।
১. ইলেকট্রোনেগেটিভিটি বা তড়িৎ ঋণাত্মকতা; ২. অ্যাসিডিটি ও বেসিসিটি, যেটা pKa দিয়ে আমরা বোঝাই; ৩. কনজুগেট অ্যাসিড ও কনজুগেট বেজ; ৪. ইলেকট্রন দাতা গ্রুপ ও ইলেকট্রন গ্রহণকারী গ্রুপ; ৫. ইলেকট্রোফাইল বা ইলেকট্রন আকর্ষী; ৬. নিউক্লিওফাইল বা নিউক্লিয়াস আকর্ষী; ৭. বন্ধন দৈর্ঘ্য ও বন্ধন শক্তি এবং ৮. স্টেরিক।
যেকোনো রাসায়নিক বিক্রিয়ায় এই বিষয়গুলোকে প্রয়োগ করে বা এই বিষয়গুলোর ভিত্তিতে অ্যানালাইসিস করে বিক্রিয়া সম্পর্কে একটা ধারণা পাওয়া যায়। আগেই বলেছি, রাসায়নিক বিক্রিয়ার মেকানিজম বা ক্রিয়াকৌশল মুখস্থ করার কিছু নেই। যুক্তি প্রয়োগ করে আমরা বিক্রিয়া সম্পর্কে ধারণা দিই বা পাই। যেসব বিক্রিয়া একেবারে নতুন, সেগুলোর মেকানিজম প্রতিষ্ঠা করতে অনেক এক্সপেরিমেন্টও করা হয়। যা–ই হোক, আমরা আগে ওপরের বিষয়গুলো নিয়ে আলোচনা করি।
০১. ইলেকট্রোনেগেটিভিটি: এর বাংলা তড়িৎ ঋণাত্মকতা। সমযোজী বন্ধনের ক্ষেত্রে দুটি পরমাণু যখন ভিন্ন হয়, তখন বন্ধন পরমাণুকে নিজের নিউক্লিয়াসের প্রতি আকৃষ্ট করার বা ধরে রাখার একটা প্রবণতা পরমাণুতে দেখা যায়। যে পরমাণুর তড়িৎ ঋণাত্মকতা বেশি, সেই পরমাণু বন্ধন ইলেকট্রনকে তার নিউক্লিয়াসের প্রতি বেশি বলে আকৃষ্ট করে। পরমাণুর নিউক্লিয়াসে যত বেশি প্রোটন থাকবে এবং পরমাণুর আকার যত কম হবে বা যত কমসংখ্যক অরবিট বা কক্ষপথ থাকবে, তার তড়িৎ ঋণাত্মকতা তত বেশি হবে।
তড়িৎ ঋণাত্মকতার মান যথারীতি নির্ণয় করা আছে এবং এসব মান মুখস্থ করার বা মনে রাখার মধ্যে কোনো কৃতিত্ব নেই। তবে ধারণা রাখতে হবে, কোন পরমাণুর ইলেকট্রোনেগেটিভিটি বেশি, কোনটির কম। এ ধারণা পর্যায় সারণি থেকেই পাওয়া যায়।
পর্যায় সারণির পিরিয়ড বা পর্যায়ের বাঁ থেকে ডানের দিকে গেলে ইলেকট্রোনেগেটিভিটি বা তড়িৎ ঋণাত্মকতা বাড়ে। আর পর্যায় সারণির একই গ্রুপের ওপর থেকে নিচে গেলে তড়িৎ ঋণাত্মকতা কমে। দ্বিতীয় পর্যায়ের প্রথম মৌল লিথিয়াম। লিথিয়াম থেকে ডান দিকে গেলে বেরিলিয়াম, বোরন, কার্বন, নাইট্রোজেন, অক্সিজেন ও ফ্লোরিন পরমাণু পাই। নিষ্ক্রিয় গ্যাস যেহেতু সমযোজী বন্ধন তৈরি করে না, সুতরাং এদের তড়িৎ ঋণাত্মকতা গণ্য করা হয় না। তাহলে বোরনের চেয়ে কার্বনের তড়িৎ ঋণাত্মকতা বেশি। আবার কার্বনের চেয়ে নাইট্রোজেন, অক্সিজেন ও ফ্লোরিনের বেশি। আসলে ফ্লোরিনের তড়িৎ ঋণাত্মকতা সবচেয়ে বেশি।
০২. অ্যাসিডিটি ও বেসিসিটি: জৈব যৌগের কার্যকর মূলকের অ্যাসিডিটি (অম্লত্ব) ও বেসিসিটি (ক্ষারত্ব) বুঝতে আমরা pKa ব্যবহার করি। খুব সহজে মনে রাখার উপায় হলো, pKa যদি কম হয়, তাহলে সেটা বেশি অ্যাসিডিক বা শক্তিশালী অ্যাসিড। pKa যদি বেশি হয়, তাহলে সেটা কম অ্যাসিডিক বা দুর্বল অ্যাসিড। বহু যৌগের pKa আমরা নির্ণয় করেছি। এগুলোর তালিকা আছে। সুতরাং pKa মুখস্থ করতে হয় না; বরং চর্চার মাধ্যমে একটা ধারণা তৈরি করতে হয়।
যেমন অ্যাসিটিক অ্যাসিডের (১) pKa ৫-এর কাছাকাছি। এটা একটা অ্যাসিড; অর্থাৎ যৌগে কার্বক্সিলিক মূলক থাকলে pKa ৫-এর কাছাকাছি হবে। তবে যদি কার্বক্সিলিক মূলকের সঙ্গে সরাসরি ইলেকট্রন উত্তোলনকারী গ্রুপ (Electron withdrawing group, EWG) থাকে, তাহলে সেটা অনেক বেশি অ্যাসিডিক হবে। আর বেশি অ্যাসিডিক মানে হলো, pKa–এর মান কমে যাবে। যেমন ট্রাইফ্লোরো অ্যাসিটিক অ্যাসিডের (TFA, ২) pKa প্রায় শূন্যের কাছাকাছি। pKa-এর মান ঋণাত্মকও হতে পারে।
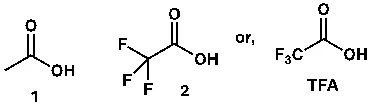
ছবি ১: ট্রাইফ্লোরো অ্যাসিটিক অ্যাসিড
ফেনলের pKa ১০-এর কাছাকাছি। তাহলে ফেনল ও অ্যাসিটিক অ্যাসিডের মধ্যে শক্তিশালী অ্যাসিড কোনটা? অবশ্যই অ্যাসিটিক অ্যাসিড। আর অ্যালকোহল, যেমন ইথানলের pKa প্রায় ১৫; অর্থাৎ ইথানল খুব দুর্বল অ্যাসিড।
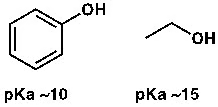
ছবি: pKa বেশি হলে অ্যাসিড হবে দুর্বল।
প্রশ্ন হলো, pKa-এর মান সম্পর্কে কেন ধারণা থাকতে হবে? কারণ, কোনো অ্যাসিড যদি শক্তিশালী হয়; অর্থাৎ pKa-এর মান যদি কম হয়, তাহলে একটা দুর্বল বেজ বা ক্ষারক ব্যবহার করলেই অ্যাসিডের প্রোটনকে বিচ্ছিন্ন করা যাবে। যেটাকে বলা হয় ডিপ্রোটনেশন (deprotonation)। অনেক ক্ষার ও ক্ষারকেরও pKa–এর মান আমরা নির্ণয় করেছি। যদিও ক্ষারকের pKa বলতে সেটার কনজুগেট অ্যাসিডের pKa বোঝানো হয়। যেমন ট্রাইইথাইল অ্যামিনের কনজুগেট অ্যাসিডের pKa প্রায় ১০।
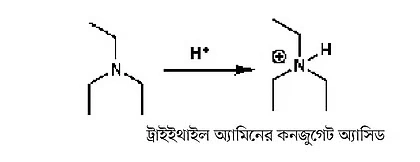
ছবি ২: ক্ষারকের pKa বলতে সেটার কনজুগেট অ্যাসিডের pKa বোঝানো হয়। এখানে ট্রাইইথাইল অ্যামিনের কনজুগেট অ্যাসিডের pKa দেখানো হয়েছে।
অ্যাসিড ও ক্ষারকের pKa মান সম্পর্কে ধারণা থাকলে আমরা সহজেই সিদ্ধান্ত নিতে পারি, কোন অ্যাসিডের সঙ্গে কোন ক্ষারক ব্যবহার করতে হবে। মনে করো, ফেনলের ডিপ্রোটনেশন করতে হবে; অর্থাৎ ফেনলের যে অ্যাসিডিক হাইড্রোজেন আছে, সেটাকে বিচ্ছিন্ন করতে হবে। তাহলে একটা বেজ বা ক্ষারক লাগবে। আমরা কোন ক্ষারক ব্যবহার করব?
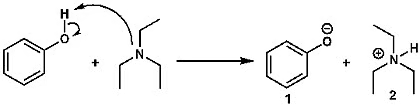
ছবি ৩: ফেনলের ডিপ্রোটনেশন
ওপরের বিক্রিয়ার কথাই চিন্তা করো। ফেনল একটা দুর্বল অ্যাসিড। কেন? কারণ, এর pKa প্রায় ১০। সুতরাং ফেনল থেকে ডিপ্রোটনেশনের মাধ্যমে ফেনক্সাইড আয়ন (১) তৈরি করতে যদি আমরা ট্রাইইথাইল অ্যামিন (TEA) ব্যবহার করি, তাহলে কি ফেনক্সাইড আয়ন তৈরি করা সম্ভব? এই উত্তরের জন্য আমাদের ট্রাইইথাইল অ্যামিনের কনজুগেট অ্যাসিডের pKa জানতে হচ্ছে। যার pKaও প্রায় ১০। যেহেতু দুটি যৌগের pKa প্রায় এক, সে ক্ষেত্রে ট্রাইইথাইল অ্যামিন ফেনলকে ডিপ্রোটনেট করতে পারবে। তবে সে ক্ষেত্রে সেটা অনেক ধীরগতির হবে। বিক্রিয়ায় ইকুইলিব্রিয়াম বা সাম্যতা বজায় থাকবে। (ট্রাইইথাইল অ্যামিন নিয়ে আগে আলোচনা হয়েছে। বিক্রিয়ার সাম্য বা ইকুইলিব্রিয়াম অন্যত্র বিস্তারিত আলোচনা করতে হবে)।
কিন্তু যদি অ্যাসিটিক অ্যাসিড ও ট্রাইইথাইল অ্যামিনের কথা চিন্তা করি, তাহলে কী হবে? অ্যাসিটিক অ্যাসিডের pKa প্রায় ৫ আর ট্রাইইথাইল অ্যামিনের (কনজুগেট অ্যাসিডের) pKa প্রায় ১০; অর্থাৎ এ ক্ষেত্রে বেজ অনেক শক্তিশালী। সুতরাং অ্যাসিটিক অ্যাসিড এবং ট্রাইইথাইল অ্যামিন খুব দ্রুত বিক্রিয়া করবে এবং এ বিক্রিয়ায় অ্যাসিটেট আয়ন (১) তৈরি হবে, যেটা আর অ্যাসিডিক অ্যাসিডে ফিরে আসবে না; অর্থাৎ এই বিক্রিয়ার ইকুইলিব্রিয়াম বা সাম্যাবস্থা হবে একমুখী।
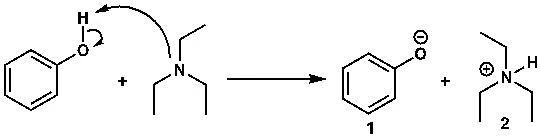
ছবি ৪: অ্যাসিটিক অ্যাসিড ও ট্রাইইথাইল অ্যামিন খুব দ্রুত বিক্রিয়া করে। এ বিক্রিয়ায় অ্যাসিটেট আয়ন (১) তৈরি হয়। বিক্রিয়াটি একমুখী।
ট্রাইফ্লোরো অ্যাসিটিক অ্যাসিড আর ট্রাইইথাইল অ্যামিনের বিক্রিয়া কত দ্রুত হবে, সেটা নিশ্চয়ই তোমরা ভাবতে পারছ। pKa–এর মান বিবেচনা করে নিজেরাই চিন্তা করতে পারো।
কনজুগেট অ্যাসিড ও কনজুগেট বেজ নিয়ে এখন আলোচনা করব। ওপরের দুটি উদাহরণ থেকেই এটা সহজে ধারণা নেওয়া যাবে। অ্যাসিড থেকে যখন অ্যাসিডিক হাইড্রোজেন (প্রাটনও বলা হয়) বিচ্ছিন্ন করা হয়; অর্থাৎ ডিপ্রোটনেশনের ফলে যে ঋণাত্মক আয়ন তৈরি হয়, সেটা হলো সেই অ্যাসিডের কনজুগেট বেজ। সুতরাং ওপরের বিক্রিয়াতে, অ্যাসিটিক এসিড থেকে তৈরি হয়েছে অ্যাসিটেইট (১) এবং অ্যাসিটেইট হলো অ্যাসিটিক অ্যাসিডের কনজুগেট বেজ।
কনজুগেট কেন বলা হচ্ছে? কারণ অ্যাসিটিক অ্যাসিড থেকে প্রোটন বিচ্ছিন্ন করলেই আমরা অ্যাসিটেইট (১) পাচ্ছি, আবার অ্যাসিটেইট যদি একটা প্রোটন গ্রহণ করে নেয়, তাহলে আবার সেই অ্যাসিটিক অ্যাসিড হয়ে যাচ্ছে। এরা যুগল। একে অপরের সঙ্গে সম্পৃক্ত।
ঠিক তেমনি, ট্রাইইথাইল অ্যামিনের কনজুগেট অ্যাসিড হচ্ছে ট্রাইইথাইল অ্যামোনিয়াম ধরনের আয়নটি (২)। আয়নটিতে একটা প্রোটন আছে বলেই আমরা এটাকে এখন অ্যাসিড বলছি। কিন্তু এই অ্যাসিড এসেছে একটা বেজ বা ক্ষারক থেকে।
সহজ কথা, অ্যাসিড থেকে হয় সেই অ্যাসিডের কনজুগেট বেজ, আর বেজ থেকে হয় সেই বেজের কনজুগেট অ্যাসিড।
অ্যাসিড যদি শক্তিশালী হয়, তাহলে কনজুগেট বেজ হবে দুর্বল। এর অর্থ কী? যেমন ওপরের উদাহরণে, অ্যাসিটিক অ্যাসিড তুলনামূলক শক্তিশালী। তাই এর কনজুগেট বেজ, অ্যাসিটেট আয়ন একটা দুর্বল বেজ বা ক্ষারক। আর এ জন্যই অ্যাসিটেট আয়ন ট্রাইইথাইল অ্যামোনিয়াম অ্যামিন থেকে প্রোটনকে ছিনিয়ে নিতে পারে না।
তাহলে ফেনক্সাইড কি অ্যাসিটেটের চেয়ে দুর্বল নাকি শক্তিশালী কনজুগেট বেজ? এর উত্তর তোমরা ভাববে।
তথ্যসূত্র:
এই লেখাটি বিজ্ঞানচিন্তা ম্যাগাজিনের প্রকাশিত প্রবন্ধ থেকে সংগৃহীত।
লেখক: ড. রউফুল আলম, গবেষক, ইউনিভার্সিটি অব পেনসিলভানিয়া, যুক্তরাষ্ট্র।











Leave a comment