অতিথি লেখক: রউফুল আলম
লেখক ও গবেষক
ইমেইল: [email protected]
এ পর্বে মূলত আলোচনা করব ইলেকট্রোফাইল ও নিউক্লিওফাইল নিয়ে। প্রসঙ্গত, অন্যান্য কিছু বিষয়ও থাকবে। ইলেকট্রোফাইল (Electrophile) কী? নামটা এসেছে ইলেকট্রনের প্রতি আসক্তি বা ইলেকট্রোফিলিসিটি থেকে। অর্থাৎ যে অণু বা অণুর অংশ (যথা কার্যকরী মূলক) ইলেকট্রন গ্রহণে আগ্রহী, সেটাকেই আমরা সাধারণভাবে বলি ইলেকট্রোফাইল। অর্থাৎ, ইলেকট্রোফাইল হলো ইলেকট্রন গ্রহীতা। ইলেকট্রোফাইলে ইলেকট্রনের ঘনত্ব কম থাকবে। এ জন্যই তো ইলেকট্রনের প্রতি আসক্তি থাকবে। জৈব যৌগে সাধারণত যৌগের বা মূলকের কার্বন পরমাণুই হবে ইলেকট্রোফাইল। অর্থাৎ কোনো কোনো কার্বন পরমাণুতে ইলেকট্রনের ঘনত্ব কম থাকবে বলেই সেই কার্বন পরমাণু ইলেকট্রন গ্রহণ করতে চাইবে। ইলেকট্রন গ্রহণের মাধ্যমে তৈরি করবে নতুন বন্ধন।
ইলেকট্রোফাইলের বিপরীত হলো নিউক্লিওফাইল। ইলেকট্রোফাইল যদি ইলেকট্রন গ্রহীতা হয়, তাহলে নিউক্লিওফাইল হলো ইলেকট্রন দাতা। ইলেকট্রন কে দিতে পারবে?—নিশ্চয়ই যার কাছে ইলেকট্রন বেশি আছে বা ইলেকট্রন ধরে রাখার সামর্থ্য যার কম।
আমরা যখন সাধারণভাবে প্রকাশ করি, তখন নিচের মতো করে লিখে প্রকাশ করা হয়। একটা তিরচিহ্নের মাধ্যমে বোঝানো হয়, নিউক্লিওফাইল ইলেকট্রোফাইলকে অ্যাটাক করছে। কিংবা একজোড়া ইলেকট্রন দিচ্ছে।
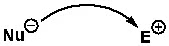
বিক্রিয়ার ক্রিয়াকৌশল (Mechanism) বুঝতে হলে ইলেকট্রোফাইল ও নিউক্লিওফাইল শনাক্ত করতে পারা খুব গুরুত্বপূর্ণ। আর এটা শনাক্তকরণের বেশ কিছু সহজ নিয়ম আছে, যেগুলো ধারাবাহিকভাবে আলোচনা করা হবে।
নিউক্লিওফাইল শনাক্ত করা তুলনামূলক সহজ। অ্যালকোহল, অ্যামিন, থায়োল—এগুলো নিউক্লিওফাইল। কারণ, অক্সিজেন, নাইট্রোজেন, সালফার এসব পরমাণুতে লোন পেয়ার বা মুক্ত জোড় ইলেকট্রন থাকে। নিচে কয়েকটি নিউক্লিওফাইলের উদাহরণ দেওয়া হলো। নিচের এ অণুগুলোর অক্সিজেন, নাইট্রোজেন এবং সালফার পরমাণুতে ইলেকট্রন পেয়ার বা লোন পেয়ার আছে। এবং কয়টি করে লোন পেয়ার আছে, সেটা তোমরা একটু চিন্তা করলেই বের করতে পারবে। আগের পর্বগুলোয় এ বিষয়ে আলোচনা করা হয়েছে।

এগুলো ছাড়াও আরও নিউক্লিওফাইল আছে, বিশেষ করে কার্বন নিউক্লিওফাইল। বিভিন্ন পর্বে সেগুলো ধারাবাহিকভাবে আসবে এবং পুনরাবৃত্তি হবে।
আগে আমরা অ্যালডিহাইড এবং কিটোন গ্রুপ সম্পর্কে জেনেছি। অ্যালডিহাইড এবং কিটোনে কার্বন-অক্সিজেনের দ্বিবন্ধন থাকে, যেটাকে আমরা কার্বনিলও বলি। কার্বনিল মূলকে অক্সিজেনের তড়িৎঋণাত্মকতা কার্বনের চেয়ে বেশি এবং কার্বন-অক্সিজেন দ্বিবন্ধন থাকে। তাই কার্বনিল হলো ইলেকট্রোফাইল। অর্থাৎ কার্বনিল মূলকের কার্বন পরমাণুতে ইলেকট্রনের ঘনত্ব কম থাকে, ফলে সেটা ইলেকট্রোফাইল।
তাহলে প্রশ্ন জাগতে পারে, অ্যালকোহলেও তো কার্বন-অক্সিজেন বন্ধন আছে। অ্যালকোহল কি ইলেকট্রোফাইল? না, অ্যালকোহল ইলেকট্রোফাইল নয়। কিংবা বলা যায়, এটিকে ইলেকট্রোফাইল হিসেবে বিবেচনা করা হয় না। বরং অ্যালকোহলকে নিউক্লিওফাইল হিসেবেই বিবেচনা করা হয়। কারণ, অ্যালকোহল হলো কার্বন-অক্সিজেন একক বন্ধন।
সুতরাং ইলেকট্রোফিলিসিটি শুধু তড়িৎঋণাত্মকতার ওপরই নির্ভর করে না। সেখানে অণুর জ্যামিতিক গঠন, দ্বিবন্ধন ও ত্রিবন্ধন, বন্ধন দৈর্ঘ্য, এমনকি অণুর যে অংশকে ইলেকট্রোফাইল হিসেবে বিবেচনা করা হচ্ছে, সেটা বন্ধনছিন্ন (Disconnect) হওয়ার পর তার স্থিতিশীলতা ইত্যাদির ওপরও নির্ভর করে। বিভিন্ন বিক্রিয়ার উদাহরণের সময় এই বিষয়গুলো আলোচনা করা হবে।
ইলেকট্রোফাইলকে শক্তিশালী বা দুর্বল ইলেকট্রোফাইল হিসেবেও ভাগ করা হয়। উদাহরণের মাধ্যমে আমরা বিষয়গুলো সহজ করে বুঝব। যেমন অ্যালকাইল হ্যালাইড হলো ইলেকট্রোফাইল। কার্বন-হ্যালোজেন বন্ধনের কারণে কার্বন পরমাণুতে ইলেকট্রনের ঘনত্ব তুলনামূলক কম থাকে।
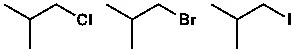
যেমন ওপরে তিনটি আইসো-বিউটাইল অণুর উদাহরণ দেওয়া হলো। এই তিনটি অণুর মধ্যে আইসো-বিউটাইল আয়োডাইড হলো শক্তিশালী ইলেকট্রোফাইল। বা বেটার ইলেকট্রোফাইল। অর্থাৎ সহজেই নিউক্লিওফাইলের সঙ্গে বিক্রিয়া করবে। নিউক্লিওফাইল সহজেই আয়োডিনকে প্রতিস্থাপিত করতে পারে, ফলে কার্বন-আয়োডিন বন্ধন ভেঙে যায়। ক্লোরিন, ব্রোমিন, আয়োডিন—তিনটি পরমাণুরই তড়িৎঋণাত্মকতা কার্বনের চেয়ে বেশি। কিন্তু কার্বন-আয়োডিন বন্ধনদৈর্ঘ্য (Bond length), কার্বন-ক্লোরিন ও কার্বন-ব্রোমিন বন্ধনের তুলনায় বড় বা বেশি। একক বন্ধন যদি বড় হয়, তাহলে সেটা দুর্বল হয়। আর দুর্বল বন্ধন ভাঙা সহজ। ফলে আইসোবিউটাইল আয়োডাইডের কার্বন-আয়োডিন বন্ধন সহজেই ভেঙে যাবে। তাই এটাকে শক্তিশালী ইলেকট্রোফাইল বলা হচ্ছে।
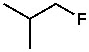
অন্যদিকে ফ্লোরিনের তড়িৎঋণাত্মকতা সবচেয়ে বেশি। সে বিবেচনায়, কার্বন-ফ্লোরিন বন্ধন তো শক্তিশালী ইলেকট্রোফাইল হওয়ার কথা। কিন্তু সেটা শক্তিশালী ইলেকট্রোফাইল না। আগেই বলেছি, তড়িৎঋণাত্মকতাই ইলেকট্রোফাইল বিবেচনার একমাত্র শর্ত নয়। ফ্লোরিনের তড়িৎঋণাত্মকতা বেশি হওয়ায় C—F বন্ধন বেশ শক্তিশালী হয়। ফলে এই বন্ধন ভাঙতে অনেক শক্তির প্রয়োজন হয়। যেটাকে আমরা বলি Bond dissociation energy (BDE); যেমন, C—F, C—Cl, C—Br, C—I এই চারটি বন্ধনের BDE যথাক্রমে, ১১০, ৮৪, ৭২ এবং ৫৭ কিলোক্যালরি/মোল। এই মানগুলো মুখস্থ করতে হবে না। শুধু ধারণা রাখলেই হবে, কোন বন্ধন শক্তিশালী আর কোনটি তুলনামূলক দুর্বল।
আরেকটা বিষয় এখানে জানা গুরুত্বপূর্ণ। সেটা হলো লিভিং গ্রুপ অ্যাবিলিটি। বিক্রিয়ায় যে গ্রুপটা বিচ্ছিন্ন হয়ে যাচ্ছে, সেটাকে বলা হচ্ছে লিভিং গ্রুপ। যেমন ওপরের উদাহরণে, Cl, Br, I—এগুলো লিভিং গ্রুপ। কারণ, নিউক্লিওফাইল যখন অ্যাটাক করে, কিংবা ইলেকট্রনজোড়া প্রদান করে, তখন হ্যালোজেন পরমাণু অ্যানায়ন হিসেবে বিচ্ছিন্ন হয় বা ত্যাগ করে।

ওপরের উদাহরণ থেকে বিষয়টা বোঝা আরও সহজ হবে (পুরো বিক্রিয়া দেখানো হয়নি)। থায়োল এখানে নিউক্লিওফাইল এবং আইসো-বিউটাইল আয়োডাইড ইলেকট্রোফাইল। আঁকার সময় আমরা প্রথম তিরচিহ্ন (নীল রং) দেব নিউক্লিওফাইল থেকে ইলেকট্রোফাইলের দিকে। যেহেতু থায়োল যথারীতি এক জোড়া ইলেকট্রন দিচ্ছে, তাই আয়োডিন এক জোড়া ইলেকট্রন নিয়ে ত্যাগ করবে। কার্বন-আয়োডিন বন্ধন ভেঙে যাবে। এটা প্রতিস্থাপন বিক্রিয়া। সুতরাং দ্বিতীয় তিরচিহ্ন (লাল রং) হবে, কার্বন-আয়োডিন বন্ধন থেকে আয়োডিনের ওপর। এই তিরচিহ্নগুলো বস্তুত ইলেকট্রনপ্রবাহকে বোঝানোর জন্য। এভাবে বিক্রিয়ার ক্রিয়াকৌশল এঁকে দেখানোর প্রক্রিয়াকে বলা হয় ‘পুশ-পুল মেকানিজম’। এবং এভাবে এঁকে বোঝানো বা ব্যাখ্যা করার নিয়মই সর্বজনীন। বিজ্ঞানের সর্বজনীন ভাষা বা রীতিটা বোঝা এবং জানা থাকা গুরুত্বপূর্ণ।
এই উদাহরণে আয়োডিন হলো লিভিং গ্রুপ, যেহেতু আয়োডিন বিচ্ছিন্ন হয়ে যাচ্ছে। আয়োডিন বিচ্ছিন্ন হচ্ছে আয়োডাইড (I-) হিসেবে। লিভিং গ্রুপ যদি বিচ্ছিন্ন হয়ে স্থিতিশীল হয়, তাহলে সেটা শক্তিশালী ইলেকট্রোফাইল। সহজ করে বললে, কেউ যদি বিচ্ছিন্ন হয়েই বেশি সুখে থাকে, স্বাচ্ছন্দ্যে থাকে, তাহলে তো সহজেই বিচ্ছিন্ন হতে চাইবে। দ্রুত বিচ্ছিন্ন হবে। নিউক্লিওফাইলকে খুব বেশি কষ্ট করতে হবে না।
সুতরাং কোনো ইলেকট্রোফাইল শক্তিশালী কি না, তা বোঝার জন্য লিভিং গ্রুপ অ্যাবিলিটিও চিন্তা করতে হয়। F, Cl, Br, I—এই পরমাণুগুলোর মধ্যে কার্বন-আয়োডিন বন্ধন থেকে আয়োডিন খুব সহজেই বিচ্ছিন্ন হয়ে যেতে চায়। কারণ, আয়োডিন, আয়োডাইড অবস্থায়ও বেশ স্থিতিশীল হয়। এবং এটা বোঝার জন্য কনজুগেইট অ্যাসিড এবং কনজুগেইট ক্ষারের যুক্তি প্রয়োগ করা যায়।
আয়োডাইড হলো হাইড্রোআয়োডিক অ্যাসিডের কনজুগেট বেজ। যেহেতু হাইড্রোআয়োডিক অ্যাসিড খুব শক্তিশালী, তাই এর কনজুগেট বেজ হবে খুব স্থিতিশীল। কারণ, শক্তিশালী অ্যাসিডের সংজ্ঞাই হলো কত সহজে, কত দ্রুত প্রোটন বা হাইড্রোজেন আয়ন দিতে পারে।
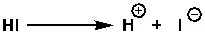
ঠিক একইভাবে বিবেচনা করলে ফ্লোরাইড (F-), আয়োডাইডের তুলনায় কম স্থিতিশীল। অর্থাৎ, লিভিং গ্রুপ হিসেবে আয়োডিন বেশ চমৎকার। ভালো লিভিং গ্রুপ। ফ্লোরিন হলো দুর্বল লিভিং গ্রুপ।
এখন আমরা ইলেকট্রোফাইল হিসেবে অ্যারোমেটিক যৌগ নিয়ে আলোচনা করব। অ্যালিফেটিক যৌগের চেয়ে এদের বৈশিষ্ট্য ব্যাখ্যায় বিভিন্ন বিষয় বিবেচনা করতে হয়।
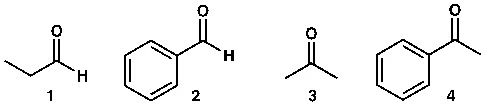
প্রথম যৌগটি হলো অ্যালিফেটিক অ্যালডিহাইড, দ্বিতীয়টি অ্যারোমেটিক অ্যালডিহাইড (বেনজালডিহাইড)। এই দুটি যৌগের মধ্যে কোন যৌগটি শক্তিশালী ইলেকট্রোফাইল? অর্থাৎ কোন যৌগটি দ্রুত নিউক্লিওফাইলের সঙ্গে বিক্রিয়া করবে?
উত্তর হলো, প্রথম যৌগটি। কেন?
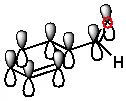
কারণ, অ্যারোমেটিক রিংয়ে পাই ইলেকট্রন আছে। ৬টি পাই ইলেকট্রন কনজুগেটেড অবস্থায় থাকে। কার্বনিল মূলকের পাই বন্ধনও দুটি পাই ইলেকট্রনের কারণেই হয়। বেনজিন রিংয়ের পাই ইলেকট্রন এবং কার্বনিল মূলকের পাই ইলেকট্রন কনজুগেটেড অবস্থায় থাকে (নিচের ছবি দেখো)। স্থিতিশীল কনজুগেশন তৈরি করে। ফলে অ্যারোমেটিক অ্যালডিহাইডের কার্বনিল মূলকের কার্বনে ইলেকট্রনের ঘনত্ব, অ্যালিফেটিক যৌগের কার্বনের তুলনায় বেশি থাকে। এ কথাটা সহজে বোঝানোর জন্য এভাবে বলেছি। বস্তুত মলিকিউলার অরবিটাল থিওরির আলোকে ভিন্নভাবে ব্যাখ্যা করা যায়। কিন্তু মলিকিউলার অরবিটাল থিউরি উচ্চতর পর্যায়ের জন্য।
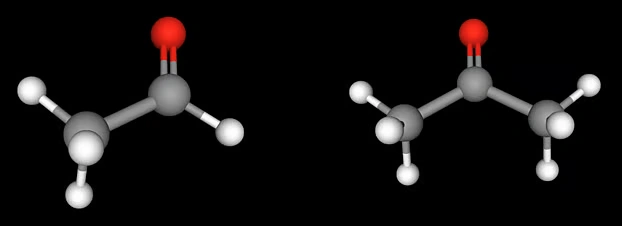
আবার তৃতীয় যৌগটি তথা অ্যাসিটোন প্রথম যৌগের তুলনায় কম শক্তিশালী ইলেকট্রোফাইল। কারণ, অ্যালডিহাইডে কার্বনিল মূলকের সঙ্গে একটি হাইড্রোজেন যুক্ত থাকে। কিটোনের বেলায় সেই হাইড্রোজেনের পরিবর্তে থাকে কার্বন। ফলে কার্বনিল মূলকের কার্বন পরমাণু অনেকটা ঢাকা বা ঘেরাও বা শিল্ডেড থাকে। অর্থাৎ স্টেরিক বেশি। নিউক্লিওফাইল সহজে অ্যাটাক করতে পারে না। নিচের ছবি থেকেও অ্যালডিহাইড এবং কিটোনের স্টেরিক পার্থক্যের কিছুটা ধারণা পাওয়া যায়।
চতুর্থ যৌগটি তথা অ্যাসিটোফেনোন আবার অ্যাসিটোনের তুলনায় কম শক্তিশালী ইলেকট্রোফাইল। কারণ, চতুর্থ যৌগটির বেলায়ও বেনজিনের পাই ইলেকট্রন, কার্বনিল মূলকের পাই ইলেকট্রনের সঙ্গে কনজুগেটেড অবস্থায় থাকে।
কার্বনিল যৌগ যেহেতু খুব গুরুত্বপূর্ণ ইলেকট্রোফাইল, তাই মনে রাখা ভালো যে সাধারণত অ্যালিফেটিক অ্যালডিহাইড অ্যারোমেটিক অ্যালডিহাইডের তুলনায় শক্তিশালী ইলেকট্রোফাইল। আবার অ্যালডিহাইড কিটোনের তুলনায় শক্তিশালী ইলেকট্রোফাইল।
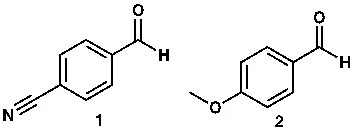
অ্যারোমেটিক অ্যালডিহাইড বা কিটোনের ইলেকট্রোফিলিসিটি, অ্যারোমেটিক রিংয়ের কার্যকরী মূলকের সঙ্গেও সম্পৃক্ত। যেমন নিচের দুটি যৌগের মধ্যে প্রথম যৌগটি শক্তিশালী বা বেটার ইলেকট্রোফাইল। কারণ, বেনজিন রিংয়ে নাইট্রাইল (R-CN) গ্রুপ যুক্ত আছে। নাইট্রাইল গ্রুপ হলো ইলেকট্রন উত্তোলনকারী বা Electron Withdrawing Group (EWG)। বলা যায়, ইলেকট্রনকে টেনে নেয়। ফলে কার্বনিল কার্বনে ইলেকট্রনের ঘনত্ব অনেক কমে যায়। ঠিক উল্টো বিষয়টি হয় দ্বিতীয় যৌগের ক্ষেত্রে। যেহেতু মেথক্সি গ্রুপ ইলেকট্রন দাতা গ্রুপ বা Electron Donating Group (EDG), তাই কার্বনিল কার্বনে ইলেকট্রনের ঘনত্ব তুলনামূলক বেশি থাকে।
পরবর্তী পর্বে আরও কিছু ভিন্ন শ্রেণির ইলেকট্রোফাইল এবং নিউক্লিওফাইল নিয়ে আলোচনা করা হবে।
তথ্যসূত্র:
এই লেখাটি বিজ্ঞানচিন্তা ম্যাগাজিনের প্রকাশিত প্রবন্ধ থেকে সংগৃহীত।
লেখক: ড. রউফুল আলম, গবেষক, ইউনিভার্সিটি অব পেনসিলভানিয়া, যুক্তরাষ্ট্র।











Leave a comment