অতিথি লেখক: রউফুল আলম
লেখক ও গবেষক
ইমেইল: [email protected]
জৈব যৌগের আধুনিক অঙ্কনরীতি নিয়ে ধারাবাহিক তিনটি পর্বে আগে আলোচনা করা হয়েছে। আশা করি, শিক্ষক ও শিক্ষার্থীরা আধুনিক রীতি চর্চা করবেন। পরের পর্বগুলোয় জৈব রসায়নের বিক্রিয়া নিয়ে কয়েক পর্বে বিস্তর আলোচনা করা হবে।
রাসায়নিক বিক্রিয়ার একটা বড় অংশজুড়েই জৈব রসায়নের বিক্রিয়া। অনেক শিক্ষার্থী রাসায়নিক বিক্রিয়া মুখস্থ করে মনে রাখে। আসলে রাসায়নিক বিক্রিয়া ব্যাখ্যা করতে হয় কিছু লজিক বা যুক্তি, ফ্যাক্ট ও থিওরির সাহায্যে। রাসায়নিক বিক্রিয়া ব্যাখ্যার জন্য এসব থিওরি বিভিন্নভাবে প্রয়োগ করে প্রতিষ্ঠিত করা হয়েছে। অনেক থিওরি প্রতিষ্ঠা করা হয়েছে বিভিন্ন এক্সপেরিমেন্টের সাহায্যে—আমরা যেটাকে বলি এক্সপেরিমেন্টাল ভ্যালিডেশন। এ ছাড়া কোয়ান্টাম কেমিস্ট্রির সাহায্যেও অনেক থিওরি প্রতিষ্ঠা করা হয়েছে।
এ পর্বে কিছু যৌগের রাসায়নিক বন্ধন ও অন্যান্য বৈশিষ্ট্য নিয়ে আলোচনা করা হবে। রাসায়নিক বন্ধন ব্যাখ্যায় বেশ কয়েকটি থিওরি আমরা প্রয়োগ করি। এ রকম খুব বেসিক একটা থিওরি হলো ‘লুইস গঠন’। লুইস গঠন দিয়ে সব বিস্তারিত ব্যাখ্যা করা যায় না। ফলে অন্যান্য থিওরি, যেমন ভিবিটি বা ভ্যালেন্স বন্ড থিওরি (Valence Bond Theory), ভিএসইপিআর বা ভ্যালেন্স শেল ইলেকট্রন পেয়ার রিপালশন থিওরি (Valence Shell Electron Pair Repulsion Theory) এবং মলিকুলার অরবিটাল থিওরি বা মট (Molecular Orbital Theory) ইত্যাদি ব্যবহার করা হয়। শেষের দুটি থিওরি মূলত উচ্চতর পর্যায়ের জন্য। আমার এই পর্বগুলো শিক্ষার্থীদের মধ্যে রাসায়নিক বিক্রিয়ার ভীতি দূর করার লক্ষ্যে। সুতরাং চেষ্টা থাকবে উচ্চতর পর্যায়ের থিওরিগুলোর সীমিত আলোচনা করে, কী করে মৌলিক বিষয়গুলো সহজ করে ব্যাখ্যা করা যায়। আগে ভীতি দূর করা, তারপর গভীর আলোচনা। মৌলিক অনেক বিষয় উচ্চতর থিওরি ছাড়াই ব্যাখ্যা করা যায়।
কোনো মৌলের গ্রুপ নম্বর থেকে আমরা বলে দিতে পারি, সে মৌলের বহিস্থ স্তরে কয়টি ইলেকট্রন আছে। খুবই সহজ একটা বিষয়। আমাকে কষ্ট করে মুখস্থ করতে হচ্ছে না। মনে রাখতে হচ্ছে না। পর্যায় সারণির দিকে তাকালেই সেটা বলে দেওয়া যায়।
এই পর্বগুলো পড়ার সময় পাশে একটা পর্যায় সারণি রাখলে সবচেয়ে ভালো হবে। পর্যায় সারণিতে অনেক কিছু দেওয়া আছে। শুধু জানতে হবে, কী করে সেখান থেকে তথ্য সংগ্রহ করে প্রয়োগ করা যায়; কী করে পর্যায় সারণির ফ্যাক্টগুলো মনে রাখা যায়।
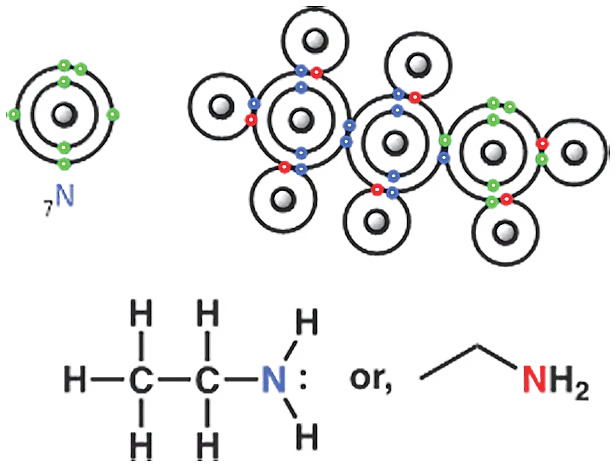
স্কুলের বইয়ে নিশ্চয় লুইস গঠন নিয়ে আলোচনা করা হয়েছে। কার্বনের পারমাণবিক সংখ্যা ৬, সুতরাং কার্বন নিউক্লিয়াসে ৬টি প্রোটন থাকবে। পরমাণু চার্জ নিউট্রাল, অর্থাৎ কোনো চার্জ থাকে না। ফলে যতটা প্রোটন থাকবে, ততটা ইলেকট্রন থাকবে। অর্থাৎ কার্বন পরমাণুতে ৬টি ইলেকট্রন আছে। ইলেকট্রন থাকলে, সেগুলোর বিন্যাসের প্রশ্ন আসে—কোন অরবিট বা স্তরে কয়টা ইলেকট্রন থাকবে। প্রথম অরবিটে সর্বোচ্চ দুটি ইলেকট্রন থাকবে। সুতরাং কার্বনের দ্বিতীয় বা সর্ববহিস্থ অরবিটে থাকবে ৪টি ইলেকট্রন। বিষয়টি মনে না থাকলে পর্যায় সারণি দেখেও বলে দেওয়া যায়।
পর্যায় সারণির গ্রুপ ১৪-এর মৌল কার্বন। গ্রুপ ১৪-এর পুরোনো নাম ছিল গ্রুপ IVA। কারণ, গ্রুপ ৩-১২ পর্যন্ত ১০টি গ্রুপে আছে ট্রানজিশন মেটাল বা অবস্থান্তর ধাতু। এই ধাতুগুলোকে বিবেচনা না করেই জৈব রসায়নের বেশির ভাগ বিক্রিয়া ব্যাখ্যা করা যায়। সুতরাং কার্বনের গ্রুপ নম্বর ১৪ থেকে যদি অবস্থান্তর মৌলের ১০টি গ্রুপ বাদ দেওয়া হয়, তাহলে কার্বনের গ্রুপ হয় ৪ (১৪-১০), যেটা বস্তুত পুরোনো গ্রুপসংখ্যা IVA-কে ইঙ্গিত করে।
কোনো মৌলের গ্রুপ নম্বর থেকে আমরা বলে দিতে পারি, সে মৌলের বহিস্থ স্তরে কয়টি ইলেকট্রন আছে। খুবই সহজ একটা বিষয়। আমাকে কষ্ট করে মুখস্থ করতে হচ্ছে না। মনে রাখতে হচ্ছে না। পর্যায় সারণির দিকে তাকালেই সেটা বলে দেওয়া যায়। যেমন সোডিয়াম গ্রুপ-১–এর মৌল। অর্থাৎ সোডিয়ামের একদম বাইরের স্তরে ১টি ইলেকট্রন আছে। একই কথা লিথিয়াম, পটাশিয়াম মৌলের ক্ষেত্রেও সত্য। নাইট্রোজেনের বহিস্থ স্তরে ৫টি ইলেকট্রন আছে। কারণ, নাইট্রোজেন গ্রুপ ৫ (১৫-১০) বা VA-এর মৌল। কার্বনের বহিস্থ স্তরে ৪টি ইলেকট্রন আছে। কারণ, কার্বন গ্রুপ ৪ (১৪-১০) বা IVA-এর মৌল। বহিস্থ স্তরের ইলেকট্রন সংখ্যা কেন গুরুত্বপূর্ণ? কারণ, রাসায়নিক বিক্রিয়া মানেই ইলেকট্রনের আদান-প্রদান। আর ইলেকট্রনের আদান-প্রদান ঘটে বহিস্থ স্তরের ইলেকট্রন থেকে। তাই সবচেয়ে বাইরের অরবিটের (স্তরের) ইলেকট্রন সংখ্যা জানাটা গুরুত্বপূর্ণ।
পর্যায় সারণির গ্রুপ ১৪-এর মৌল কার্বন। গ্রুপ ১৪-এর পুরোনো নাম ছিল গ্রুপ IVA। কারণ, গ্রুপ ৩-১২ পর্যন্ত ১০টি গ্রুপে আছে ট্রানজিশন মেটাল বা অবস্থান্তর ধাতু। এই ধাতুগুলোকে বিবেচনা না করেই জৈব রসায়নের বেশির ভাগ বিক্রিয়া ব্যাখ্যা করা যায়।
কার্বন পরমাণুর বহিস্থ স্তর বা অরবিটে চারটি ইলেকট্রন থাকে। তাহলে কার্বন পরমাণু আর কয়টা ইলেকট্রন ধারণ করতে পারবে? আরও চারটি। কেন? কারণ, আরও ৪টি ইলেকট্রন হলে কার্বনের বাইরের স্তরে ৮টি ইলেকট্রন হবে। ফলে সেটি নিয়নের মতো স্থিতিশীল ইলেকট্রন বিন্যাস গঠন করতে পারে। এই যে ৮টি ইলেকট্রন পূর্ণ করার প্রবণতা, এটাকে বলা হয় অকটেট বা অষ্টক নীতি। অষ্টক নীতির মাধ্যমে মিথেন ও ইথেনের লুইস গঠন সহজেই আঁকা যায়। লুইস গঠনের মাধ্যমে এখানে সমযোজী বন্ধনকেই ব্যাখ্যা করা হয়েছে।
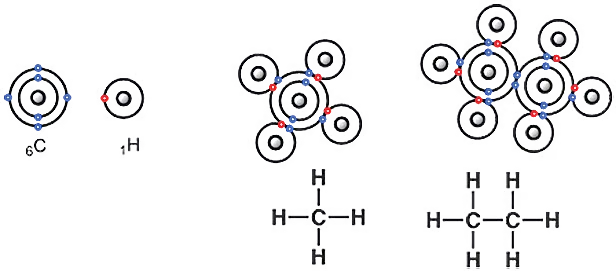
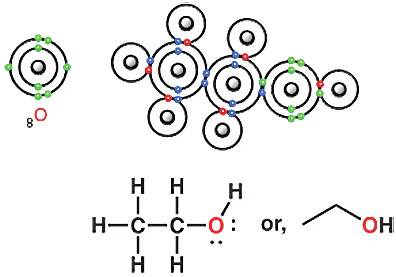
ইথেনের গঠন জেনে নিয়ে, ইথানল বা ইথাইল অ্যালকোহলের গঠনও আঁকা যায়। ইথানল খুব গুরুত্বপূর্ণ যৌগ। যেহেতু এই অণু বা যৌগে একটা OH গ্রুপ আছে, সেহেতু এটাকে অ্যালকোহল বলা হয়।
ইথানলের অক্সিজেন পরমাণুও অষ্টক নীতি অনুসারে কার্বন ও হাইড্রোজেনের সঙ্গে বন্ধন তৈরি করে।
কার্বনের ক্ষেত্রে কি আমরা কোনো ইলেকট্রন দেখি, যেটা বন্ধনে অংশগ্রহণ করেনি? এমন ইলেকট্রন দেখি না। কিন্তু অক্সিজেনের ক্ষেত্রে দেখা যাচ্ছে। অক্সিজেনের চারটা ইলেকট্রন (সবুজ রং) রাসায়নিক বন্ধনে অংশ নেয়নি। দুই জোড়া ইলেকট্রন বন্ধনে অংশগ্রহণ করেনি, তাই এদের বলা হয় লোন পেয়ার (Lone pair) বা নন-বন্ডিং ইলেকট্রন পেয়ার।
অক্সিজেনের ক্ষেত্রে এমন দুই জোড়া ইলেকট্রন দেখা যায়। যেহেতু ইথানলের অক্সিজেনে দুটি লোন পেয়ার বা দুই জোড়া অবন্ধনকৃত ইলেকট্রন আছে, সেহেতু সব অ্যালকোহল যৌগের ক্ষেত্রেই এ বিষয় প্রযোজ্য। আমরা মিথানল, আইসোপ্রোপানল কিংবা যেকোনো অ্যালকোহল যৌগের ক্ষেত্রেই এ বিষয় প্রয়োগ করতে পারব।
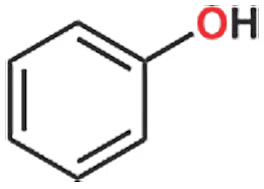
অ্যালকোহল মূলক যদি বেনজিনের সঙ্গে যুক্ত থাকে, তাহলে সেটাকে বলা হয় ফেনল এবং এ–জাতীয় যৌগের ক্ষেত্রেও অক্সিজেন পরমাণুতে কিন্তু দুটি লোন পেয়ারই আছে। এটা একটা গুরুত্বপূর্ণ ফ্যাক্ট, যেটা মনে রাখতে হবে।
পর্যায় সারণিতে অক্সিজেনের ঠিক নিচের মৌলটা হলো সালফার। একই গ্রুপের মৌল। সুতরাং তাদের বৈশিষ্ট্যের মধ্যে অনেক মিল থাকবে। অক্সিজেনের পরিবর্তে সালফার থাকলে যৌগের নামে ‘থায়ো’ বা ‘থায়োল’ যুক্ত করা হয়। যেমন ইথানল থেকে ইথেনথায়োল। আর ফেনল থেকে থায়োফেনল।
কার্বন-সালফার বন্ধন, কার্বন-অক্সিজেনের তুলনায় বড় হবে। এটাও পর্যায় সারণি থেকেই বোঝা যায়। অক্সিজেন হলো দ্বিতীয় পর্যায়ের মৌল। এ জন্যই অক্সিজেনে দুটি অরবিট। সালফার হলো তৃতীয় পর্যায়ের মৌল।
ইথেনথায়োল হোক আর থায়োফেনল হোক, সালফার পরমাণুতে কিন্তু দুটি লোন পেয়ারই থাকছে। সহজ যুক্তি হলো, অক্সিজেন ও সালফার একই গ্রুপের মৌল। সুতরাং অ্যালকোহলের অক্সিজেনে যদি দুটি লোন পেয়ার থাকে, তাহলে অনুরূপ সালফার যৌগের সালফারেও দুটি লোন পেয়ারই থাকবে। একটা লজিক প্রয়োগ করা হলো এখানে। এই লজিকটা মনে রাখতে হবে। আমাকে আলাদা করে সালফারের ইলেকট্রন বিন্যাস চিন্তাও করতে হচ্ছে না।
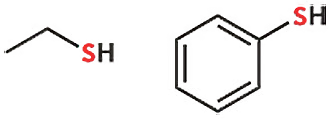
ইথানলের কার্বন-অক্সিজেন বন্ধন দৈর্ঘ্য আর ইথেনথায়োলে কার্বন-সালফার বন্ধন দৈর্ঘ্য কি একই হবে? বন্ধন দৈর্ঘ্য হলো মূলত দুটি পরমাণুর নিউক্লিয়াসের মধ্যে দূরত্ব। বন্ধন দৈর্ঘ্য মুখস্থ করার দরকার নেই। ধারণাটা থাকলেই হলো। কার্বন-সালফার বন্ধন, কার্বন-অক্সিজেনের তুলনায় বড় হবে। এটাও পর্যায় সারণি থেকেই বোঝা যায়। অক্সিজেন হলো দ্বিতীয় পর্যায়ের মৌল। এ জন্যই অক্সিজেনে দুটি অরবিট। সালফার হলো তৃতীয় পর্যায়ের মৌল। তাই সালফারে তিনটি অরবিট থাকবে। অরবিট বেশি হওয়ার মানে হলো পরমাণুর আকার বড় হওয়া। আর পরমাণুর আকার বড় হলে রাসায়নিক বন্ধনও বড় হয়ে যায়। রাসায়নিক বন্ধন বড় হলে সে বন্ধন দুর্বল হয়। অর্থাৎ সে বন্ধন বিভাজনে বা ভাঙতে কম শক্তির প্রয়োজন হয়। এই ফ্যাক্টগুলোও মনে রাখা প্রয়োজন।
এবার আমরা চলে যাব নাইট্রোজেন যৌগে। ইথানলের অনুরূপ নাইট্রোজেন যৌগের নাম হলো ইথাইল অ্যামিন। ইথানলের অক্সিজেনের বদলে নাইট্রোজেন মৌল যুক্ত হলো। লুইস গঠন থেকেই বলে দেওয়া যাচ্ছে, ইথাইল অ্যামিনের নাইট্রোজেনে কিন্তু দুটি লোন পেয়ার নেই। একটি লোন পেয়ার বা এক জোড়া ইলেকট্রন, যেগুলো বন্ধন গঠন করেনি।
অ্যামিন যৌগের নাইট্রোজেনে এক জোড়া ইলেকট্রন বা একটা লোন পেয়ার থাকবে। প্রথম যৌগটি ইথাইল অ্যামিন, দ্বিতীয়টি ডাই আইসোপ্রোপাইল ইথাইল অ্যামিন (DIPEA), তৃতীয়টি ট্রাই ইথাইল অ্যামিন (TEA) ও শেষ যৌগটি অ্যানিলিন।
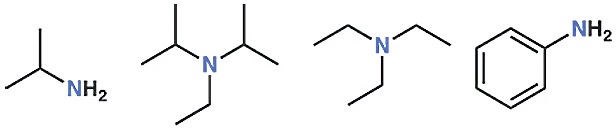
অনেক শিক্ষার্থী প্রশ্ন করতে পারে, নাইট্রোজেনের বেলায় দুটি হাইড্রোজেন কেন বন্ধন করল। কেনই–বা একটা লোন পেয়ার হলো। এই প্রশ্নগুলোর উত্তর নাইট্রোজেনের বহিস্থ স্তরের ইলেকট্রন সংখ্যা থেকেই বলে দেওয়া যায়। নাইট্রোজেনের ক্ষেত্রে বাইরের অরবিটে ৫টি ইলেকট্রন থাকে। সুতরাং নাইট্রোজেনের আর মাত্র ৩টি ইলেকট্রন হলেই অষ্টক পূর্ণ হয়। সুতরাং একটি নাইট্রোজেন পরমাণু দুটি হাইড্রোজেন এবং একটি কার্বন থেকে মোট তিনটি ইলেকট্রন নিতে পারে। ফলে তিনটি বন্ধন তৈরি করে (ভিন্ন রং দিয়ে দেখানো হয়েছে)। সুতরাং নাইট্রোজেনের ৫টি ইলেকট্রনের সব কটি তো বন্ধন করতে পারছে না। সে ক্ষেত্রে নাইট্রোজেনের বাইরের অরবিটে মোট ১০টি ইলেকট্রন হয়ে যাবে। অষ্টক নীতি অনুসরণ করছে না। তাই মাত্র ৩টি ইলেকট্রন বন্ধন গঠন করবে, বাকি দুটি বা এক জোড়া বন্ধনে অংশ নেবে না। এই সাধারণ ও সহজ লজিক প্রয়োগ করে অন্য যৌগগুলোকেও ব্যাখ্যা করা যায়।
তাহলে অ্যামিন যৌগের নাইট্রোজেনে এক জোড়া ইলেকট্রন বা একটা লোন পেয়ার থাকবে। প্রথম যৌগটি ইথাইল অ্যামিন, দ্বিতীয়টি ডাই আইসোপ্রোপাইল ইথাইল অ্যামিন (DIPEA), তৃতীয়টি ট্রাই ইথাইল অ্যামিন (TEA) ও শেষ যৌগটি অ্যানিলিন। ভিন্ন ভিন্ন অ্যামিন যৌগ। কিন্তু প্রতিটি যৌগের নাইট্রোজেনে একটি লোন পেয়ারই আছে। কার্বন-নাইট্রোজেন এবং কার্বন-অক্সিজেন একক বন্ধনের দৈর্ঘ্যের মধ্যে খুব বেশি পার্থক্য নেই। এই দুটি বন্ধন প্রায় একই দৈর্ঘ্যের এবং একই শক্তির।
নির্দিষ্ট করে অক্সিজেন, সালফার ও নাইট্রোজেনের লোন পেয়ার নিয়ে আলোচনা করেছি। কারণ, এই যৌগগুলো উদাহরণ হিসেবে বারবার আসবে।
এই পর্ব শেষ করব একটা বিশেষ ধরনের যৌগ দিয়ে। ওপরের প্রতিটি উদাহরণে অক্সিজেন, সালফার ও নাইট্রোজেনে লোন পেয়ার দেখেছি। এই উদাহরণে আমরা কোনো লোন পেয়ার পাব না; বরং একটা শূন্যতা দেখা যাবে!
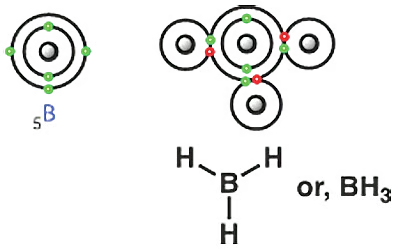
নিচের যৌগটির নাম বোরেইন। বোরন হলো গ্রুপ ১৩-এর মৌল। যেটাকে আমরা গ্রুপ (১৩-১০) = ৩, বা IIIA–এর মৌলও বিবেচনা করতে পারি। অর্থাৎ বোরনের একদম বাইরের স্তরে তিনটি ইলেকট্রন আছে। সুতরাং বোরন তিনটি হাইড্রোজেনের সঙ্গে বন্ধন করতে পারবে এবং মোট ৬টি ইলেকট্রন অর্জন করতে পারবে। অষ্টক নীতি অনুযায়ী ৮টি ইলেকট্রনের জন্য বোরনের আরও দুটি ইলেকট্রন দরকার। সুতরাং এ ক্ষেত্রে বোরনের কোনো লোন পেয়ার বা অবন্ধনকৃত ইলেকট্রন নেই; বরং একটা শূন্যতা আছে। বোরন একটি লোন পেয়ার বা এক জোড়া ইলেকট্রন গ্রহণের জন্য আগ্রহী বা উদ্গ্রীব হয়ে থাকবে।
নাইট্রোজেনের বাইরের অরবিটে মোট ১০টি ইলেকট্রন হয়ে যাবে। অষ্টক নীতি অনুসরণ করছে না। তাই মাত্র ৩টি ইলেকট্রন বন্ধন গঠন করবে, বাকি দুটি বা এক জোড়া বন্ধনে অংশ নেবে না।
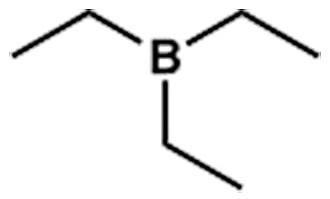
ওপরের ট্রাই ইথাইল অ্যামিনের (TEA) মতো ট্রাই ইথাইল বোরেইন (TEB) যৌগও আছে। পার্থক্য হলো অ্যামিনের ক্ষেত্রে নাইট্রোজেনে একটি লোন পেয়ার আছে। আর বোরনে কোনো পেয়ার নেই। উল্টো লোন পেয়ার গ্রহণ করতে সক্ষম।
বোরন (B) এক জোড়া ইলেকট্রন বা একটি লোন পেয়ার গ্রহণে আগ্রহী। কার্বনের কোনো লোন পেয়ার নেই (মিথেন, ইথেনের উদাহরণ দেখো)। নাইট্রোজেনের একটি লোন পেয়ার আছে। অক্সিজেনের আছে দুটি। আর ফ্লোরিনের আছে তিনটি।
B, C, N, O, F—এই মৌলগুলো পর্যায় সারণিতে ধারাবাহিকভাবে আছে। নম্বর লাইন দিয়ে, এদের লোন পেয়ারকে ১, ০, ১, ২, ৩ এভাবেও চিন্তা করা যায়। কী চমৎকার একটা ফ্যাক্ট। কখনো কি এভাবে ভেবে দেখেছেন?
তথ্যসূত্র:
এই লেখাটি বিজ্ঞানচিন্তা ম্যাগাজিনের প্রকাশিত প্রবন্ধ থেকে সংগৃহীত।
লেখক: ড. রউফুল আলম, গবেষক, ইউনিভার্সিটি অব পেনসিলভানিয়া, যুক্তরাষ্ট্র।











Leave a comment